질소화합물
다른 표기 언어대부분의 질소원소는 질소화합물의 제조에 사용된다.
많은 양의 질소는 수소와 반응시켜 톡 쏘고 자극적인 냄새가 나는 무색의 암모니아(NH3) 기체를 얻는 데 쓰인다. 암모니아를 합성하는 중요한 상업적 방법은 하버법이다. 암모니아는 상업적으로 많이 쓰이는 2가지 주요 질소화합물 중의 하나로서 여러 용도로 다른 중요한 질소화합물을 만드는 데 쓰인다. 상업적으로 합성되는 많은 양의 암모니아는 질산(HNO3)과 질산염으로 전환되며 이것은 질산의 에스터나 염이 된다.
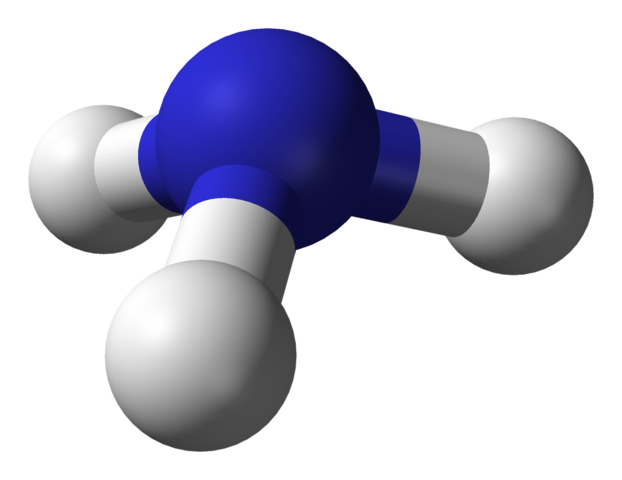
암모니아는 암모니아-소다법에서 소다회(Na2CO3) 제조, 그리고 로켓 연료와 많은 공정에 사용하는 무색의 액체인 하이드라진(N2H4)을 제조하는 데 사용한다(암모니아-소다 법). 그밖에 상업적으로 중요한 질소 화합물인 질산은 무색의 고부식성 액체로 비료·염료·약·폭발물의 제조에 널리 쓰인다. 질산암모늄(NH4NO3)은 암모니아와 질산의 염으로 가장 많이 사용되고 있는 인공비료의 질소 성분이다.
질소는 산소와 결합하여 산화질소(Ⅰ)(아산화질소, [N2O])·산화질소(Ⅱ)(NO), 그리고 산화질소(Ⅳ)(이산화질소[NO2]) 등 몇 가지 산화물을 생성한다.
모든 산화질소는 휘발성이 매우 크다. 웃음 가스[笑氣]라고도 하는 아산화질소는 마취제로 쓰이며, 흡입하면 약한 히스테리 증상을 유발한다. 산화질소는 산소와 빠르게 반응하여 이산화질소를 생성한다. 이산화질소는 질산 제조공정의 중간물질로서 다양한 화학공정에서 강력한 산화제로 쓰이며 로켓 연료로도 쓰인다(질소산화물). 질소와 금속이 고온에서 직접 결합하여 생기는 고체인 질소화물도 중요하다.
질소화물에는 합금강을 암모니아 속에서 가열하는 질소화(窒素化) 공정에서 생산되는 경화제 등이 있다(질환법). 붕소·타이타늄·지르코늄·탄탈럼의 질소화물은 특수한 용도로 쓰인다. 예를 들면 질소화붕소(BN)의 동소체는 다이아몬드 정도의 굳기를 갖고 있으며 쉽게 산화되지 않는 성질이 있어 고온용 연마제로 사용한다. 무기사이안화물은 사이안화 이온(CN-)을 포함하고 있다. 사이안화수소 또는 포르모나이트릴(HCN)은 휘발성이 크고 매우 유독한 독가스로 훈증·선광 등 여러 공정에 쓰인다.
사이안 또는 옥살로나이트릴((CN) 2) 역시 화학반응의 중간물질과 훈증제로 쓰인다(사이아노겐). 무기 또는 유기아지드화물은 3개의 질소원자가 하나의 원자단(-N3)으로 이루어진 화합물이다. 대부분의 아지드화물은 불안정하고 충격에 대단히 민감하다. 아지드화납(Pb(N3)2) 같은 일부 아지드화물은 기폭장치와 뇌관으로 쓰인다.
할로젠화합물처럼 아지드화물은 쉽게 다른 물질과 아지드기가 치환반응을 하여 다양한 화합물을 생성한다.
질소는 많은 유기화합물을 형성한다. 이들 화합물 중 대부분은 암모니아·사이안화수소·사이안·아질산·질산에서 유도된 화합물이다. 유리질소화합물의 자세한 설명에 대해서는 '유기화합물' 항목 참조.