아르곤
다른 표기 언어 Argon| 분류 | 비활성 기체 |
|---|---|
| 원자번호 | 18 |
| 원소기호 | Ar |
| 상태 | 기체 |
| 원자량 | 40 |
| 녹는점 | -189.2℃ |
| 끓는점 | -185.7℃ |
| 밀도 | 1.784g/ℓ(1기압, 0℃) |
| 원자가 | 0 |
| 전자배열 | 2-8-8 또는 1s22s22p63s23p6 |
요약 지구 대기 가운데 질소, 산소 다음으로 많은 비중을 차지하는 무색·무취·무미의 기체. 원소기호는 'Ar', 원자번호는 18이다. 비활성 기체 가운데 지구상에서 가장 풍부하게 존재한다. 1785년 헨리 캐번디시가 아르곤의 존재를 예측했고, 1894년 영국의 과학자 레일리 경이 공기 중에서 분리했다. 아르곤 원자의 최외각에는 8개의 전자가 채워져 있어서 매우 안정하므로 화학적으로 비활성이다. -185.8℃에서 무색의 액체로 응축되며, -189.4℃에서 결정성 고체가 된다. 전구의 봉입 기체, 진공관, 가이거 계수기 등 비활성 기체 용도로 널리 쓰인다.
목차
접기-
정의
-
연구사
-
특성
-
산출
-
활용

정의
무색·무취·무미의 비활성 기체. 원소기호는 'Ar', 원자번호는 18이다. 지구 대기 가운데에서 질소, 산소 다음으로 많은 비중을 차지하며, 비활성 기체 가운데 지구상에서 가장 풍부하게 존재한다. .
연구사
1785년 헨리 캐번디시가 대기 중의 질소를 조사하던 중, 공기 중에 고작 1/120 정도의 비활성 성분이 들어 있다고 결론을 내렸으나 인정받지 못했고, 100년이 넘도록 잊혀져 있었다. 1894년 영국의 과학자 레일리 경과 윌리엄 램지가 공기 중에서 산소를 제거해 만든 질소는 암모니아와 같은 질소화합물로부터 제조한 질소보다 늘 밀도가 0.5% 정도 더 크다는 것을 발견한 후에 비로소 업적을 인정받았다.
산소와 질소를 제거한 무거운 기체는 지구상에서 발견된 최초의 비활성 기체이며, 화학적으로 비활성이기 때문에 아르곤(헬륨은 1868년 분광계를 사용해 태양의 스펙트럼을 측정해 이를 해석하던 중 발견했음)이라고 명명했다.
특성
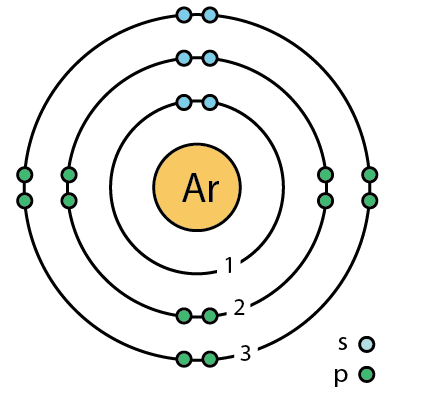
아르곤의 최외각에는 8개의 전자가 채워져 있어서 매우 안정하므로 화학적으로 비활성이다. 아르곤 원자는 아르곤 원자끼리 또는 다른 원소와 결합하지 않는다. 아르곤 원자는 얼음의 결정이나 유기화합물인 히드로퀴논 등 다른 물질의 분자 내에 있는 바구니 모양의 구멍에 기계적으로 끼어들어가기도 한다(아르곤 내포화합물이라고 함).
아르곤은 -185.8℃에서 무색의 액체로 응축되며, -189.4℃에서 결정성 고체가 된다. -122.3℃ 이상의 온도에서는 압력을 아무리 가해도 액화되지 않으며, 이 온도에서 최소한 48기압의 압력을 가해야 액화된다. 12℃에서 물 100㎖에 3.94㎖의 아르곤이 녹는다. 저압에서 전기방전할 때 연한 적색을 띠며, 고압에서는 강청색을 띤다.
산출
아르곤은 대기 무게의 1.3%, 부피의 0.94%를 차지하며, 암석에서는 아르곤 기체가 암석 내부까지 들어와서 저장되어 있는 형태로 발견된다. 지구가 생성된 이래 지구상에서 산출되는 아르곤의 대부분은 포타슘(칼륨)을 함유하는 광물에 들어 있는 희유 천연방사성 동위원소인 포타슘-40(40K)의 붕괴에 의한 것이다.
아르곤 기체는 지각운동에 의해 지금도 형성되고 있는 암석에서 서서히 대기 중으로 새어나온다. 40K의 붕괴에 의해 아르곤-40(40Ar)이 생성되는 것을 이용하면 지구의 나이를 계산할 수 있다(포타슘-아르곤 연대측정법). 지구에서 산출된 천연 아르곤은 3개의 안정한 동위원소, 즉 36Ar(0.34%), 38Ar(0.06%), 40Ar(99.60%)의 혼합물이다.
활용
아르곤은 액화된 공기를 분별증류해 대량으로 얻을 수 있다. 전구의 봉입 기체, 진공관, 가이거 계수기에 쓰이며, 알루미늄·스테인리스강과 같은 금속의 아크 용접, 타이타늄·지르코늄·우라늄과 같은 금속의 생산과 제조, 실리콘·저마늄과 같은 반도체의 결정성장을 위한 가공에 필요한 비활성 기체로도 널리 쓰인다(→ 열용융).