고체
다른 표기 언어 solid , 固體요약 액체·기체와 함께 물질의 3가지 기본상태의 하나.
고체는 물질이 존재하는 3가지 상태 가운데 하나로, 일정한 모양을 갖고 있다. 고체는 온도와 압력의 변화에 따라 액체나 기체로 변한다. 고체를 일정 온도 이상으로 가열하면 액체로 변하는데 이를 융해라고 한다. 하지만 드라이아이스처럼 어떤 고체는 액체상태를 거치지 않고 바로 기체로 변하는데 이것을 승화라고 한다.
고체를 구성하는 원자나 분자가 반복적이고 규칙적으로 배열되어 있어 결정성을 갖는다. 또한 분자간의 거리가 좁고 인력이 매우 강하기 때문에 외부로부터 힘을 가해도 모양이 쉽게 변하지 않는 특징이 있다. 고체는 결합 형태에 따라 이온고체, 공유고체, 금속고체, 분자고체, 수소결합고체 등이 있다.
구조와 성질
결합형태에 따른 분류
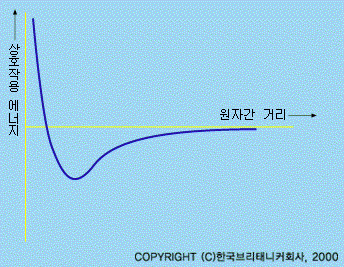
원자 에너지, 보다 적절하게 말하면 자유 에너지라고 부르는 열역학적 변수는 원자가 비교적 질서있는 3차원 구조를 취하면 감소한다.
고체는 액체나 증기 등 어느 것에서도 생길 수 있는데, 증기상태에서 고체가 될 때 감소하는 에너지를 응집 에너지라고 하며 2종류의 상호작용의 결과로 나타난다. 즉 원자가 너무 근접하지 않도록 하는 반발작용 및 결정이 원자로 분리되지 않도록 안정하게 유지하는 흡인작용(또는 결합작용)과의 합으로 나타난다. 무한히 먼 거리에서의 상호작용 에너지를 0으로 놓을 때, 상호작용 에너지는 분자가 서로 가까워짐에 따라 감소하지만 너무 가까워지면 급격히 증가한다.
이 에너지가 최소로 되는 곳은 인력과 반발력이 균형을 이루는 곳이고, 이것은 2원자분자의 원자간 거리를 나타낸다. 상호작용 에너지는 고체를 이온고체·공유고체·금속고체·분자고체·수소결합고체의 5군으로 분류하는 기본이 된다. 실제 고체를 논할 때에는 결합형태가 앞에서 말한 5개의 이상적인 것들 중에서 2개 이상에 걸쳐 있는 경우가 많다는 것을 알아야 한다.
즉 비소화갈륨·안티몬화인듐·인화알루미늄 등의 화합물은 공유성과 이온성 모두가 원자결합에 기여하고 있고, 반면에 비스무트나 안티몬 등의 원소는 금속성과 공유성이 부분적으로 원자결합에 기여하고 있는 원소의 예이다.
이온고체
이온결합은 알칼리 금속처럼 전자에 대한 친화력(親和力)이 약해서 양이온을 형성하기 쉬운 원소와 할로겐 원소처럼 전자에 대한 친화력이 강해서 음이온을 형성하기 쉬운 원소 사이에서 생긴다.
이러한 형태의 고체에서는 양전하를 띠게 될 원자로부터 음전하를 띠게 될 원자로 원자간 전자이동이 일어나고, 그 결과 고체는 양전하 원자(양이온)와 음전하 원자(음이온)로 구성된다. 염화나트륨·플루오르화나트륨·염화세슘 같은 단순한 이온고체에서는 이 전자이동의 결과로 각각의 이온이 닫힌 전자껍질을 갖게 된다.
각 이온들은 공간에서 다른 전하를 띠는 이온 사이에 작용하는 쿨롱 인력이 같은 전하를 띠는 이온 사이의 쿨롱 반발력과 같아지도록 배열된다.
이러한 이온결합으로부터 다양한 결정구조가 만들어지는데, 보통 염화세슘형·염화나트륨형·황화아연형 등의 3가지 형이 있다(그림2). 이것들의 결정구조에서 각각의 이온은 이온간에 작용하는 쿨롱 힘의 결과로 전하가 반대인 이온을 가장 인접한 이온으로 갖게 된다.
응집 에너지에 쓰이는 주요한 것은 마델룽 에너지(Madelung energy)라고 불리는 정전기 에너지이다.
이 에너지를 계산할 때는 모든 하전이온 사이의 쿨롱 상호작용을 모두 더해야 된다. 안정한 원자배열에서 이 에너지는 인력으로 작용한다. 정전기 에너지, 즉 쿨롱 상호작용 에너지는 각 이온의 전하인 ±q의 곱을 이온간 거리 r로 나눈 q2/r의 형태로 구할 수 있다. 따라서 이온간 거리가 감소하면 상호작용의 크기는 증가하기 때문에, 각 이온이 반대부호의 전하를 띠는 인접 이온으로 둘러싸여 있는 조밀결정구조의 총정전기 에너지는 음(-)이 된다.
이온간 거리가 더욱 감소하면 쿨롱 상호작용의 1/r의존성 때문에 결정 에너지가 음의 방향으로 증가한다. 그러나 이온들이 너무 가까워지면 인접 이온의 닫힌 전자껍질이 공간적으로 겹쳐지기 시작하면서, 그결과 이온간 거리가 짧아지고 에너지는 급격히 증가한다.
이 반발력의 기본원인은 2개의 전자가 동일한 양자수를 가질 수 없다는 파울리의 배타 원리에서 찾을 수 있다.
이온결정의 대부분의 특징은 전하의 이동방식에 의해 결정된다. 예를 들어 전기장이 가해지면 이온의 운동에 의해서 전류가 생기는데, 이 현상은 음으로 하전된 이온의 양극(+)쪽으로의 확산, 양이온의 음극(-)쪽으로의 확산 또는 이들 양쪽의 확산에 의존한다. 그러므로 결정의 전기 전도도는 이온의 확산 정도를 반영하며, 온도에 대해서 지수함수적(指數函數的)으로 증가한다.
왜냐하면 열에너지의 증가는 원자도약비율을 증가시키기 때문이다.
공유고체
공유결합은 중성원자의 원자가전자(또는 외각전자)가 결정 내의 가장 가까운 원자 사이에 공유될 때 생긴다.
이 원자배열에서는 각 원자가 가장 가까운 원자와 전자를 공유함으로써 닫힌 전자 외각을 완성한다. 공유결합은 일반적으로 각 인접 원자에서 하나씩 빌려온 2개의 전자를 지니는데, 닫힌 껍질은 8개의 전자를 필요로 하기 때문에 원자배열은 각 원자가 4개의 가장 가까운 원자를 갖는 형태로 된다. 그 결과 사면체 원자배열이 생기며, 공유결합 고체는 종종 그림 2에 제시된 다이아몬드형 구조를 취한다.
전자의 에너지 상태를 기술하는 변수 중의 하나는 전자 자신의 스핀 방향인데, 결합쌍을 형성하는 전자가 서로 반대방향의 스핀을 가질 때 전자간의 상호작용은 인력으로 나타난다. 고체의 결합원자 에너지는 가장 가까운 원자 사이의 전자공유에 의해서 각 원자의 전자껍질이 완성됨에 따라 원자가 자유원자상태에서 가졌던 에너지보다 감소한다.
이 감소된 에너지가 공유고체의 응집에너지로 된다. 이상적인 공유결합은 탄소·규소·게르마늄 같은 주기율표의 14족 원소의 결합에서 볼 수 있다.
이 원소들은 4개의 원자가전자를 가지고 있는데, 이 4개의 원자가전자는 4면체 공유결합에 참여하고 있다. 다른 원소도 공유결합을 할 수 있다. 예를 들어 수소분자의 2개의 수소원자는 공유결합을 형성하고 있다. 또한 비소화갈륨이나 안티몬화인듐 같은 13족 원소와 15족 원소로 이루어진 화합물도 부분적으로 공유결합을 형성하고 있는데, 13족 원소인 갈륨이나 인듐은 3개의 원자가전자를, 15족 원소인 비소나 안티몬은 5개의 원자가전자를 공유결합에 제공하고 있다.
이 화합물들의 원자구조는 황화아연형 구조라고 부른다.
공유결합 결정의 성질은 결합을 형성하는 전자의 편재성(偏在性)에 따라 결정된다. 이러한 물질로는 다이아몬드 같은 절연체와 게르마늄 같은 반도체가 있다. 두 경우 모두 전류를 운반하는 것은 편재화된 상태(바닥상태)로부터 더 높은 에너지 상태로 열에 의해서 들뜨게 된 전자다.
이 들뜬 상태에서는 전자가 편재하지 않으며, 외부 전기장에 반응하여 운동할 수 있다. 전자가 원자가전자대(결합에 관여하여 편재해 있는 전자상태)에서 전도대(전기장이 가해지면 원자간의 공간을 운동할 수 있는 상태)로 들뜨게 되면 전기 전도성을 얻는데, 이 전기 전도성은 온도에 대해서 지수함수적으로 증가한다.
금속고체
구리·알루미늄·나트륨 등 많은 금속원소로 형성되는 금속결합의 특징은 금속고체 내의 원자가전자의 비편재적 성질에서 비롯된다.
1개의 원자가 금속결정 내로 들어가면, 원자 파동함수로 표시되는 원자가전자의 성질은 그 전자가 결정 내에서 양으로 하전된 다른 원자의 이온중심으로 접근하기 때문에 변화를 보인다. 그 결과 새로 얻어진 원자가전자의 파동함수는 금속의 체적 전체와 관련되며, 따라서 각각의 원자가전자는 더이상 특정 이온 중심에 결합될 수 없다.
이러한 비편재적 원자가전자의 평균 에너지는 일부는 고체 전체에 미치는 운동 에너지이고 일부는 이온중심과 다른 원자가전자와의 상호작용에 의한 위치에너지인데, 이 에너지들도 결정이 될 때 감소하여 응집 에너지를 제공한다.
금속결정은 원자가전자의 자유전자적 성격에 의해서 높은 전기 전도도를 지닌다. 예를 들어 구리의 전기 전도도는 약 106[Ω·㎝]-1이다. 원자가전자는 전기장이 가해지면 어떠한 열적 들뜸도 필요로 하지 않고, 마치 공유결정의 경우처럼 전도대 속에서 열에 의해 들뜨게 할 필요없이 운동할 수 있다.
그러나 이 경우에도 전자의 운동은 제한되어 있다. 전자가 결정 내 격자결함과 만나거나 열에너지에 의해서 진동하고 있는 원자에 접근하면 산란되고 만다. 그러므로 원자의 열진동의 크기가 증가하면 자유전자의 운동이 방해를 받기 때문에, 온도가 상승함에 따라 전기 전도도는 감소한다.
분자고체
회유기체와 몇 가지 분자고체는 고체상태에서 반데르발스 결합, 즉 분자결합을 나타낸다.
결합은 완전히 채워진 바깥 전자껍질을 지닌 원자나 이온화되지 않은 분자 사이에서 생기기 때문에 그 힘이 약하며 저온에서만 안정하다. 반데르발스 결합은 각 원자 내에서 원자핵이 전자의 전하분포의 중심으로부터 벗어난(변위) 결과로 생기는데, 그 변위는 중성의 원자나 분자가 서로 접근할 때 일어난다.
이 유도된 전하변위는 전기쌍극자(다른 부호로 하전된 2개의 극을 가진 물체)를 형성하며, 이 전기쌍극자는 인접한 유도전기 쌍극자와 상호작용하여 결정에너지를 감소시켜서 작은 응집에너지를 만든다.
유도된 전기 쌍극자 사이의 끌어당기는 작용은 도달거리가 아주 짧아서, 원자간 거리의 마이너스 6승(1/거리6)에 비례하면서 변화한다. 이 끌어당기는 상호작용은 원자를 접근시켰을 때에 원자의 채워진 전자껍질이 겹치기 시작하면서 생기는 반발하는 상호작용과 균형을 이룬다.
반발하는 상호작용이 생기는 이유는 동일한 에너지, 즉 동일한 4개의 양자수를 지닌 전자가 접근할 경우 전자는 이온고체의 경우와 마찬가지로 파울리의 배타원리에 따라 동일한 상태를 차지할 수 없게 되고, 따라서 높은 에너지 상태를 차지하게 되기 때문이다.
이러한 분자결합의 성질 때문에 전자는 각 원자에 편재(偏在)하며, 따라서 분자고체는 전기 전도성을 띠지 않는다. 결국 분자고체는 절연체(絶緣體)이다. 이런 고체에서 전자를 편재상태로부터 비편재상태로 들뜨게 하려면 매우 많은 에너지가 필요하다.
분자고체
회유기체와 몇 가지 분자고체는 고체상태에서 반데르발스 결합, 즉 분자결합을 나타낸다.
결합은 완전히 채워진 바깥 전자껍질을 지닌 원자나 이온화되지 않은 분자 사이에서 생기기 때문에 그 힘이 약하며 저온에서만 안정하다. 반데르발스 결합은 각 원자 내에서 원자핵이 전자의 전하분포의 중심으로부터 벗어난(변위) 결과로 생기는데, 그 변위는 중성의 원자나 분자가 서로 접근할 때 일어난다.
이 유도된 전하변위는 전기쌍극자(다른 부호로 하전된 2개의 극을 가진 물체)를 형성하며, 이 전기쌍극자는 인접한 유도전기 쌍극자와 상호작용하여 결정에너지를 감소시켜서 작은 응집에너지를 만든다.
유도된 전기 쌍극자 사이의 끌어당기는 작용은 도달거리가 아주 짧아서, 원자간 거리의 마이너스 6승(1/거리6)에 비례하면서 변화한다. 이 끌어당기는 상호작용은 원자를 접근시켰을 때에 원자의 채워진 전자껍질이 겹치기 시작하면서 생기는 반발하는 상호작용과 균형을 이룬다.
결정구조
개요
결정고체가 반복적 단위의 규칙적 배열로 이루어져 있다는 사실은 17세기부터 일반적으로 인식되어왔지만, 결정을 형성하는 원자의 3차원 주기적 배열은 20세기초에 비로소 확인되었다.
1912년 라우에는 원자의 주기적 배열에서 출발하여 X선 회절이론을 발표했고, 1913년에는 브래그가 X선 회절을 이용하여 염화소듐·브로민화포타슘·염화포타슘·아이오딘화포타슘 같은 몇 가지 이온결정의 구조를 밝혔던 것이다.
그 이후 비교적 간단한 원소의 구조로부터 단백질과 DNA의 구조에 이르기까지 엄청나게 많은 물질의 구조를 결정하기 위해서 X선·전자선, 더 나아가서 중성자선의 회절이 이용되어왔다.
원자결합의 성질은 고체의 구조에 일정한 제한을 가하기는 하지만 그것을 결정하지는 않으며, 같은 종류의 원자결합을 가진 각종 물질로부터 다양한 결정이 형성된다.
구조의 다양성
결정고체 내의 원자는 격자라고 불리는 3차원의 반복적 배열을 이루며 놓여 있고, 격자 내의 임의의 점의 위치는 한 그룹의 결정축에 대해서 결정된다.
격자나 결정축은 공간 내의 실제 원자 위치를 기술하기 위해 고안된 수학적 수법이지 실체는 아니다. 그러나 이 개념들은 많은 결정성질을 쉽게 기술할 수 있게 하며 표준적인 결정축과 격자가 정해져 있다. 단위격자를 이루는 점의 집단은 기본적인 반복단위이고, 격자는 3개의 결정축에 따른 단위격자의 병진에 의해 형성된다.
결정구조는 삼사정계(三斜晶系)·단사정계(單斜晶系)·사방정계(斜方晶系)·정방정계(正方晶系)·입방정계(立方晶系)·삼방정계(三方晶系)·육방정계(六方晶系)의 7개 결정계와 브라베 격자(Bravais Lattice)라고 불리는 14개의 단위격자를 사용하여 표시하는 것이 보통이다.
어떤 것을 선택하는가는 중요하지 않으며, 공간 내 점의 반복적 배치인 모든 격자는 이 14개의 단위격자 중 어느 하나에 포함된다.
실제로 결정구조를 기술하려면 모든 원자의 위치를 브라베 격자에 맞추어야 한다. 간단한 경우에는 격자점 하나에 원자 하나가 대응한다. 예를 들면 구리의 구조는 면심입방(面心立方) 격자로 각 격자점당 하나의 구리원자가 있으며, 철은 상온에서 체심입방(體心立方) 격자구조로 격자점당 하나의 철원자가 있다.
대부분의 결정은 더 복잡한 구조를 가지고 있으며, 각 격자점당 여러 개의 원자가 대응하고 있다.
공유결합 결정을 대표하는 다이아몬드의 구조는 면심입방 격자의 각 격자점에 2개씩의 원자를 지니며, 또 이온결합을 특징짓는 염화소듐의 구조는 면심입방 격자의 각 격자점이 소듐 이온과 염화 이온 2개의 이온을 가진다.

각 격자점당 원자수가 더욱 많은 복잡한 구조도 많이 알려져 있다.
예를 들어 망간 원소는 742℃ 이하에서는 단위격자당 58개 원자를 지닌 단순입방 격자의 결정구조, 742~1,092℃ 사이에서는 단위격자당 20개의 원자를 가진 단순입방 격자의 결정구조이고 1,095~1,133℃ 사이에서는 단위격자당 4개 원자를 가진 면심입방 격자의 결정구조이며, 1,133℃ 이상 녹는점 사이에서는 단위격자당 2개 원자를 가진 체심입방 격자의 결정구조를 취한다.
결정의 대칭성에 따라서 많은 거시적인 성질들이 결정 내에서의 방향 의존성을 나타낸다.
즉 전기 전도도, 자기 투과도, 탄성계수, 유전율 같은 성질들은 결정구조의 대칭성을 반영한다. 예를 들어 염화소듐 같은 입방정계 결정은 등방적(等方的)이라 유전율과 같은 성질이 측정방향에 상관없이 일정하지만, 삼방계의 결정구조를 가진 수정 등은 2개의 유전율을 갖는다. 따라서 실험치는 측정방향에 따라서 달라진다. 또 구리·저마늄·염화소듐 등의 입방정계 결정은 3개의 서로 다른 탄성계수를 가지며, 아연·카드뮴·마그네슘 등의 육방정계 결정은 5개의 탄성계수를 가진다.
공유결합·이온결합·수소결합의 특성에 따라 각각의 경우에 생길 수 있는 결정구조의 다양성이 제한된다.
예를 들어 쿨롱 상호작용의 결과로 이온결정의 구조는 각 이온의 가장 인접한 이온이 반대부호로 하전되는 형태를 취한다. 양이온의 반지름이 작은 1가 이온의 고체는 염화소듐형 구조의 결정으로 되고, 몇 개의 2가 이온 고체도 같은 결정구조를 취한다. 양이온의 반지름이 비교적 큰 1가 이온고체는 염화세슘형 구조를 취한다. 어떤 이온결정은 황화아연형의 구조를 취하는데, 양이온과 음이온이 다이아몬드형 구조처럼 정사면체를 이루며 배열된다.
분자 내의 원자가 이온결합을 하고, 분자 자신은 반데르발스 힘에 의한 층간결합을 갖는 층상구조를 이루면서 배열될 때는 훨씬 복잡한 결정구조가 형성된다.
공유결합 원소는 원자가 정사면체를 형성하며 배치되어 있는 다이아몬드형 구조를 이룬다. 부분적으로는 이온적 성질도 나타내는 공유결합 화합물에서는 황화 아연형 구조가 형성된다. 또한 수소결합에 의해서 단백질이나 DNA 같은 유기결정(有機結晶)의 구조는 상당한 제한을 받는다.
결정에 관한 이러한 제한은 분자유전학에서 대단히 중요하다. 금속결합은 결정구조를 제한하는 일이 거의 없기 때문에 여러 종류의 결정구조가 관측된다.
몇 개의 중합체(重合體) 물질은 규칙적인 3차원 구조의 결정을 형성하는데, 이것들은 많은 정상적인 결정고체와 달리 완전하지 못하다. 기본적인 중합체의 단위는 공유결합한 탄소원자와 수소원자, 특정한 중합체에 첨가된 산소나 플루오린 같은 원자, 또는 다른 공유결합을 포함하는 원자단으로 이루어진다.
이러한 기본단위인 단위체(單位體)는 공유결합을 해서 수천 개 단위체의 반복으로 만들어진 긴 고리가 된다. 폴리에틸렌은 간단한 중합체의 예이다. 기본단위체는 단일결합으로 연결된 3원자단(H-C-H)인데, 이 단위체가 탄소원자간의 공유결합에 의해서 반복적으로 결합하여 고리를 형성한다. 고리의 길이는 단위체 수천 개에 해당한다.
격자결함
일반적으로 고체는 완전한 결정이 아니라 보통 각종 격자결함을 포함하고 있다.
그중의 몇 가지가 그림 3에 나와 있다. 고체는 보통 결정입자라고 불리는 작은 3차원 영역의 집합으로 이루어져 있고 각 결정입자 내에서 결정축은 일정한 방향을 갖지만, 결정입자 상호간에는 결정축의 방향이 서로 다르다. 이러한 결정입자를 나누는 경계면은 결정입자 경계라고 불리며 면결함을 일으킨다. 각 결정입자 내부에서는 결정입자의 완전성이 '어긋나기'라고 불리는 선결함에 의해 교란되는데, 이것은 원자배열의 국부적(局部的) 변화에 의한 것이다.
격자 내의 각각의 점에는 많은 격자결함, 즉 점결함이 존재한다. 원자가 차지하는 몇 개의 위치는 외래원자에 의해서 점유되어 있다. 외래원자는 규칙적인 위치에 놓여 있는 본래의 원자를 치환하거나 원자와 원자간의 작은 틈새에 위치한다. 쇼트키 결함(Schottky defect)이라고 말하는 빈자리나 빈자리의 집단들은 원자를 정규 격자위치로부터 제거하여 격자위치를 비우게 함으로써 형성된다.
이온결정에서는 점결함이 종종 하전되어 있기 때문에, 점결함은 전기적 중성을 유지하도록 집단으로 형성된다. 이와 같은 이온결정의 점결함은 종종 색중심, 즉 빛을 흡수해서 결정을 착색하는 원인이 된다.
앞에서 말한 격자결함 이외에도 많은 기본적인 결정 불완전성이 존재한다. 이것들 중의 하나는 포논, 즉 격자의 진동에너지의 양자이다. 광양자와 마찬가지로 포논도 파동성과 입자성을 함께 가지고 있다. 포논의 특성은 열용량·열전도도·빛의 흡수 등 고체의 몇 가지 성질을 결정한다.
절연체와 공유고체에서는 광양자 흡수에 의한 이온화, 포논에 의한 열들뜸, 강한 전기장에 의해서 자유전자와 자유양전하 구멍이 생긴다.
역학적 성질
탄성과 소성
고체가 갖고 있는 유용성(有用性)의 대부분은 응력(應力)을 지탱할 수 있는 능력에 있다.
실제로 고체의 수직응력(표면에 수직으로 가해진 응력)과 전단응력(표면에 평행으로 가해진 응력)을 지탱할 수 있는 능력이 바로 고체를 기체나 액체로부터 구별하는 것이다. 응력을 가한 결과 일어나는 변형은 탄성변형(彈性變形)·소성변형(塑性變形)·비탄성변형 등의 3가지로 분류된다. 이것들은 응력이 가해지는 속도에 대한 의존성 및 응력이 제거되었을 때의 변형상태에 따라 명확하게 정의되어 있다.
탄성변형은 가해진 응력에 응답하는 순간적인 형상변화로서, 응력이 제거되면 즉시 원상태로 완전하게 돌아간다.
이때 영구적 변형은 없다. 탄성변형과는 대조적으로 소성변형은 영구적 형상변화를 가져오는데, 이 영구적 형상변화는 응력이 가해지는 속도에 좌우되며 응력을 제거해도 원래 상태로 돌아오지 않는다. 비탄성변형은 앞에서 말한 2가지 변형의 중간에 위치하는데, 이 변형이 원래 상태로 돌아오는 것은 응력을 가하는 속도와 응력이 가해졌던 시간에 좌우된다. 이 3가지 형태의 변형은 보통 강철 용수철이나 고무밴드의 늘어남(탄성변형), 종이 클립의 휘어짐(소성변형), 강하게 당겨진 바이올린 현의 진동진폭의 감소(비탄성변형) 등에서 볼 수 있다.
이 현상들을 앞에서 말한 3가지 변형형태에 맞추는 것은 쉽지 않지만 응력을 가했을 때의 총체적 결과는 이 3가지 변형이 조합된 것이 된다.
탄성과 소성
고체의 온도상승에 따른 격자진동과 전자들뜸은 고체의 많은 성질에 커다란 영향을 미친다.
이 열적 영향을 이해하려고 하는 시도는 고체물리학의 발전에서 중심적인 역할을 해왔다. 18세기에는 고체비열에 관한 초기의 정량적 실험결과를 해석하기 위해 무게가 없고 투명하며 고온에서 저온으로 흐르는 '칼로릭 유체'(열량을 갖는 유동체)라는 개념이 도입되었다. 19세기에 들어와서 기체의 행동에 관한 연구가 이루어지고 기체 분자운동론이 받아들여지게 되자 비로소 열을 분자의 운동으로 해석하게 되었다. 기체에 관한 발전된 이론을 고체의 열적 성질을 이해하기 위해서 적용하는 것은 고전물리학의 틀 안에서는 불가능했지만, 그 시도는 20세기초에 양자물리학 발전의 계기를 제공했다.
고체의 주요한 열적 현상으로는 비열(比熱)이나 비열과 질량의 곱인 열용량 및 열전도(熱傳導)가 있다.
기체의 분자운동론에 기초하여, 각 원자는 에너지를 운동에너지 및 원자를 가장 근접한 원자와 연결시키고 있는 변형된 결합(즉 원자를 가장 인접한 원자에 연결하는)의 위치에너지로서 진동방식(진동수와 진폭)으로 저장하고 있다는 것을 알게 되었다.
원자의 운동이 양자역학을 사용하지 않고 기술될 수 있는 온도 영역에서 한 방식당 에너지는 볼츠만 상수 k(1.381×10-23J/KT)와 절대온도 T의 곱의 1/2인 kT/2이다.
고체 내의 각 원자의 진동은 3개의 독립적인 방향의 진동으로 기술된다. 즉 3개의 운동에너지 방식과 3개의 위치 에너지 방식이 있기 때문에, 고체 내의 원자 1mol(몰)의 고전적 에너지는 아보가드로수를 N으로 할 때 (3+3)×(kT/2)×N=3NkT가 된다.
격자진동으로서 저장된 에너지 외에 높은 에너지 상태로의 전자들뜸도 일어날 수 있다.
금속에서 이 전자적 비열은 온도에 대해서 1차함수적으로 증가하는데, 격자진동에 의한 비열에 비하면 작다.
고체 내의 온도기울기에 따른 열전도는 전자와 포논 또는 이 2개에 의한 에너지 수송을 의미한다. 상온 이상의 온도에서 금속의 열전도도의 대부분은 전자에 의한 열수송으로 설명된다. 저온에서의 열전도도는 단지 포논에 의한 열수송에만 의존한다.
격자 내에서의 포논과 전자의 운동은 불순물, 결정입자 경계, 외측면, 어긋나기 등과 같은 격자결함에 의한 산란, 그리고 다른 포논과 전자에 의한 산란 때문에 제한된다. 이 산란과정들이 고체의 열전도도를 결정한다.