안녕하세요 지식인에서 추가질문 요청했던 사람입니다!
-
게시물 수정 , 삭제는 로그인 필요
안녕하세요! 방금 지식인에서 질문 드렸던 사람입니다! 우선 답변 남겨주신 내용 중 사진 (9-27)과 (9-28)이 뭔지 알려주실 수 있나요??
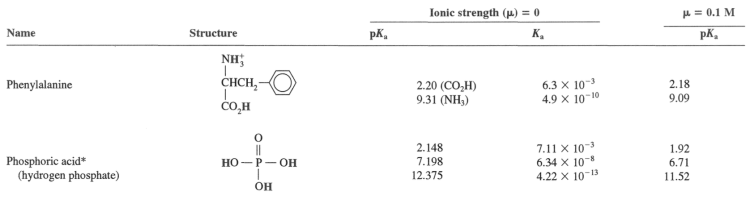
그리고 제가 인산에 수산화 나트륨을 적정한 실험에서 각 구간의 pH의 실험 값과 이론 값을 비교해보는 학술 탐구를 진행 하고 있습니다.
알려주신대로 두 pKa를 더해서 2로 나누는 방법 말고는 다른 방법으로 당량점을 구할 수 는 없을까요?
일반화학 책을 참고해서 1차~3차 당량점, 각 당량점 사이 부분을 이론적으로 계산하고 싶은데, 고3인지라 이해하기 어려운 부분이 많습니다..ㅜㅜ
파란색으로 표시한 각 부분의 pH를 구하는 방법을 알려주시면 감사하겠습니다!!