크립톤
다른 표기 언어 Krypton| 분류 | 비활성 기체 |
|---|---|
| 원자번호 | 36 |
| 원소기호 | Kr |
| 상태 | 기체 |
| 원자량 | 84 |
| 녹는점 | -156.6℃ |
| 끓는점 | -152.3℃ |
| 밀도 | 3.733g/l, (1기압, 0℃) |
| 원자가 | 0, 2 |
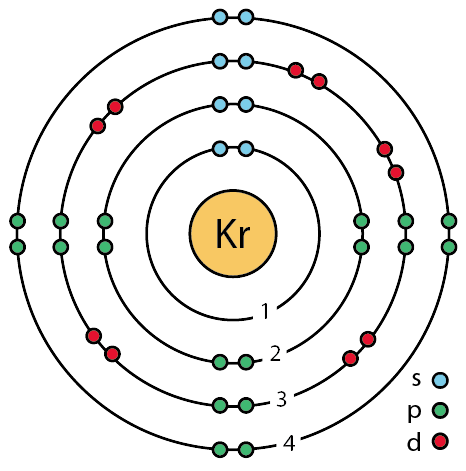
| 전자배열 | 2-8-18-8 또는 (Ar)3d104s24p6 |

화합물을 잘 형성하지 않으며, 공기보다 3배 정도 무겁고 무색·무미·무취이다. 천연 가스와 온천·화산에서 내뿜는 기체에 미량 존재하나 지구 대기에는 매우 많아 1.11ppm 정도이다. 1898년 영국의 화학자 윌리엄 램지와 모리스 트래버스가 액화공기를 전부 끓여 증발시킨 잔류물에서 발견했다. 상업적으로는 액화공기를 분별증류하여 소량 생산한다.
형광등과 속사진의 섬광등에 쓰이며, 방사성 동위원소인 85Kr는 금속 표면에 있는 흠을 발견(원자가 금속 표면의 작은 흠에 모여 내놓는 방사선으로 검출함)하는 데 쓰인다.
저압에서 크립톤이 들어 있는 유리관에 전류를 통하면 푸른색을 띤 백색광이 나온다. 안정한 동위원소인 86Kr이 내놓는 주홍색 스펙트럼선에 해당하는 파장은 매우 선명하기 때문에 1960~83년 국제 표준미터법의 기준이 되었다(1m는 이 스펙트럼선 파장의 165만 763.73배와 같음). 크립톤은 오랫동안 반응성이 없다고 생각되었으나, 1960년대초 플루오린과 직접 결합하여 화합물 이플루오린화크립톤(KrF2)을 만들고, 그밖에 극소수의 크립톤 화합물이 존재한다는 보고가 있다.
물이나 다른 분자의 바구니 구조 속에 잡혀 있는 내포화합물이 알려져 있다. 크립톤 분자는 단일 원자로 이루어진다. 천연 크립톤은 안정한 6개 동위원소인 84Kr(56.90%), 86Kr(17.37%), 82Kr(11.56%), 83Kr(11.55%), 80Kr(2.27%), 78Kr(0.35%)의 혼합물이다. 또한 우라늄 핵분열 및 다른 핵반응으로 약 20개의 방사성 동위원소가 만들어진다고 알려져 있다.85Kr의 반감기는 10.76년이다.