코발트
다른 표기 언어 Cobalt 동의어 Co| 분류 | 전이 금속 |
|---|---|
| 원자번호 | 27 |
| 원소기호 | Co |
| 상태 | 고체 |
| 원자량 | 59 |
| 녹는점 | 1,495℃ |
| 끓는점 | 2,927℃ |
| 원자가 | 2, 3 |
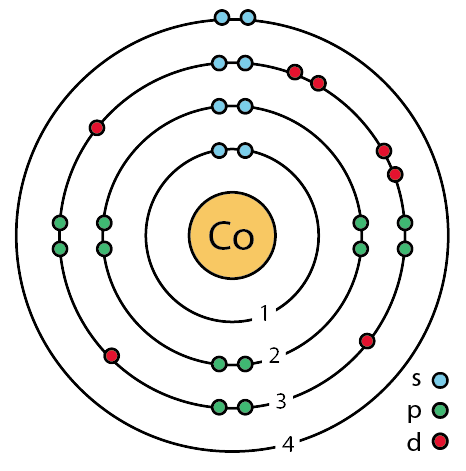
| 전자배열 | 2-8-15-2 또는 (Ar)3d74s2 |
| 비중 | 8.9(20℃) |
목차
접기-
산출·성질·용도
-
코발트 화합물

특히 내열성 합금과 자성 합금 제조에 쓰인다. 코발트 화합물은 수세기 동안 유약과 도자기에 청색을 내는 데 사용되어왔지만, 금속은 1735년경 스웨덴의 화학자 게오르그 브란트에 의해 분리되었다. BC 3000년경 이집트의 작은 조상과 페르시아의 구슬 목걸이, 폼페이 폐허에서 발견된 유리, 중국의 당대·명대의 청자에서 검출된다. 구리와 섞인 광석에 코볼드(kobold)라는 이름을 최초로 붙였으나 코발트는 독성이 있는 비소를 포함하고 있는 코발트 광석에서 발견되었다. 1742년 브란트는 이 광석의 청색이 코발트 때문이라고 단정했다.
산출·성질·용도

코발트는 널리 분포되어 있으나 지각에는 0.001%만이 분포되어 있다. 지상과 운석의 천연 니켈-철, 태양과 별의 대기에서 소량 발견된다. 또한 천연수, 해저단괴, 토양, 동식물과 휘코발트석·리네아이트·스커테루다이트·비코발트석·헤테로게나이트·코발트화 같은 광물에서 다른 원소와 결합되어 있는 화합물 상태로 존재한다. 철·니켈·구리·은·망간·아연·비소 등 많은 광석에서 부산물로 미량 회수된다.
코발트는 반추동물(소·양)의 영양과 중원소를 함유하는 유일한 비타민인 비타민 B12의 형태로 사람의 적혈구 세포의 성숙에 꼭 필요한 미량원소이다. 연마된 코발트는 연한 푸른색이 도는 은백색의 금속으로 2개의 동소체가 알려져 있으며 417℃ 이하에서는 안정된 육방밀집구조를, 이보다 더 높은 온도에서는 안정된 면심입방구조를 각각 갖는다. 1,121℃(금속이나 합금의 퀴리점 중 가장 높은 온도)에서도 강자성을 띠므로 높은 온도에서 자성을 필요로 하는 용도에 쓰인다.
천연 코발트는 모두 안정한 동위원소인 코발트-59(59Co)이며, 원자로에서 이것으로부터 중성자를 방사시키면 반감기가 가장 긴 인공 방사성 동위원소인 60Co(반감기 5.3년)이 얻어진다. 60Co에서 나오는 감마선은 X선이나 라듐의 알파선 대신에 공업제품의 검사에서 내부구조·결함·이물질을 알아내거나 암치료·불임연구에 쓰이며, 생물학과 공업에서 방사성 추적자로 사용된다. 세슘-137(137Cs)은 반감기(30년)가 길기 때문에 공업과 방사의학에서 점차 60Co 대신에 사용하고 있다. 생산되는 대부분의 코발트는 특수 합금에 쓰인다(→ 코발트-60).
전세계 생산량의 1/4은 알니코(Alnico) 같은 영구자석용 자성합금으로 쓰이고, 또다른 1/4은 높은 온도에서도 금속의 고유한 성질이 유지되는 합금과 녹는점 부근(강철이 연해지는 온도)에서 사용되는 초합금에 사용된다. 또한 표면경화 합금, 공구강, 저팽창성 합금(유리-금속 봉합용), 일정 계수 합금(시계의 정밀한 유사용[遊絲用]), 그리고 치과와 정형외과에 쓰이는 합금으로 쓰인다.
코발트는 경화된 탄화물에 가장 적합한 기질이다. 미세하게 쪼개진 코발트는 자발적으로 발화하며, 이보다 큰 덩어리는 공기 중에서 비교적 비활성이지만 300℃ 이상에서는 활발하게 산화된다.
코발트 화합물
화합물에서 코발트의 산화수는 보통 +2, +3이지만 +4, +1, 0, -1의 산화수도 갖는다고 알려져 있다.
2가 코발트(Co2+, 물에서 안정한 이온)의 화합물을 코발트(Ⅱ) 화합물이라 하고, 3가 코발트(Co3+) 화합물을 코발트(Ⅲ) 화합물이라 한다. 2가·3가 코발트는 수많은 배위화합물(착물)을 만든다. 코발트(Ⅲ)은 백금을 제외하고는 다른 어떤 금속보다도 많은 착물을 형성하는 이온이며, 착물의 배위수는 보통 6이다.
코발트는 산소와 2개의 이성분화합물인 산화코발트(Ⅱ)(CoO)와 사산화삼코발트(Co3O4)를 만든다. 사산화삼코발트는 코발트의 원자가 2가와 3가 모두를 포함하고 공업용 산화코발트의 40%를 차지하며, 요업·유리·에나멜 생산과 촉매, 코발트 금속 분말 제조에 쓰인다. 코발트의 가장 중요한 염(鹽) 중의 하나는 황산코발트(CoSO4)인데, 이것은 전기도금, 건조제 제조, 농업에서 목초지의 덧거름으로 쓰인다.
그밖의 코발트(Ⅱ)염은 촉매, 건조제, 코발트 금속 분말, 다른 염 제조에 중요하게 쓰인다. 염화코발트(Ⅱ) (CoCl2·6H2O, 공업용)는 분홍색의 액체로 탈수시키면 청색이 되고, 촉매제조와 습기지시약으로 쓰인다. 인산코발트(Ⅱ)(Co3 (PO4)2·8H2O)는 도자기에 그림을 그리고 유리를 채색하는 데 사용된다.