염소
다른 표기 언어 Chlorine , 鹽素| 분류 | 할로젠 원소 |
|---|---|
| 원자번호 | 17 |
| 원소기호 | Cl |
| 상태 | 기체 |
| 원자량 | 35 |
| 녹는점 | -100.98℃ |
| 끓는점 | -34.6℃ |
| 밀도 | 3.214g/ι(1기압, 0℃) |
| 산화수 | -1, +1, +3, +5, +7 |
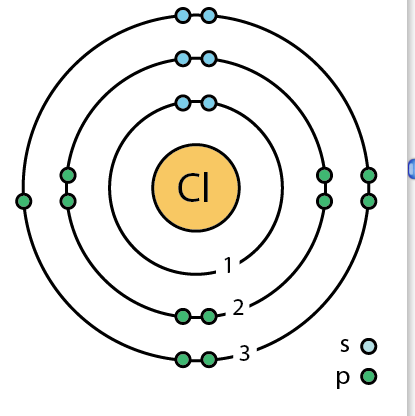
| 전자배열 | 2-8-7 또는 1s22s22p63s23p5 |

독성과 부식성이 있는 황록색 기체로 눈과 호흡기관을 자극한다. 공기보다 2.5배 정도가 무겁고, -34℃에서 액화된다. 1774년 카를 빌헬름 셸레가 염산과 이산화망가니즈를 반응시켜 최초로 제조했으나, 1810년 헴프리 데이비가 분해되지 않고 수소 원자와 함께 염산을 구성하는 원소임을 밝히고 이를 염소라 명명하기 전까지는 화합물이라 생각했다. 가장 가벼운 할로젠 원소인 플루오린보다 희박하지만 얻기 쉽고, 지각의 0.013%를 차지한다.
유리 염소는 염화수소가 주성분인 화산기체의 성분으로 소량 존재한다. 염소 이온(Cl-)은 해수(무게의 1.9%)와 카스피 해, 사해, 미국 유타 주의 그레이트솔트 호와 같은 내해에서 발견되는 주요음이온이다. 증발잔류광물에서(암염같이 소듐과 결합한 형태로) 발견되며, 염소인회석과 소달라이트에서도 발견된다. 천연 염소는 2개의 안정한 동위원소인 염소-35(35Cl:75.53%)와 37Cl(24.47%)의 혼합물이다.

염소 이온은 고등동물의 체액과 위에서 분비되는 소화액인 염산에 존재한다. 독 가스인 염소 기체는 제1차 세계대전에서 최초로 화학전에 쓰였다. 염소 기체는 질식작용이 있고, 흉부를 압박하고, 인두후두를 조이며, 폐부종을 유발시킨다. 대기 중에 2.5㎎/ℓ만 있어도 수 분 내에 사망하며, 부피의 0.0001% 이하만 있어도 몇 시간 후에 죽는다. 이보다 훨씬 낮은 농도에서도 강한 냄새가 나므로 주의해야 한다.
염소는 소금물을 전기분해시키거나, 용융된 염화소듐을 전기분해시켜 소듐을 제조할 때 부산물로 얻는다(→ 소금). 염소와 염소 화합물은 제지공업과 섬유산업의 표백제, 도시의 상수도 소독제, 가정용 표백제·살균제, 유기·무기 화합물 제조에 쓰인다.
염소 분자(Cl2)는 염소 원자 2개로 이루어지며, 거의 모든 원소(산소·플루오린·질소·탄소·영족기체는 제외)와 직접 결합해 염화물을 만든다. 대부분의 금속과 결합해 이온성 결정 화합물이 되고, 준금속 또는 비금속과 결합해 유용한 유기화합물이 된다. 염화물에서 염소의 산화수는 보통 -1이지만, +1(하이포염소산 이온(ClO-)),+3(아염소산 이온(ClO2-)), +5(염소산 이온(ClO3-)), +7(과염소산 이온(ClO4-))도 있다.
일산화염소(Cl2O), 이산화염소(ClO2), 육산화이염소(Cl2O6), 칠산화이염소(Cl2O7) 등 4개의 산화물은 모두 반응성이 크고 불안정해서 간접적으로 합성한다. 이온 화합물 속에 붙어 있는 중할로젠 원소인 브로민과 아이오딘과 치환되며, 유기화합물에 첨가반응이나 치환반응을 한다. 염소는 용매·염료·플라스틱·합성고무에 사용되는 많은 유기화학약품을 합성하는 데 직접 또는 중간물질로 쓰인다.