리튬
다른 표기 언어 Lithium| 분류 | 알칼리 금속 |
|---|---|
| 원자번호 | 3 |
| 원소기호 | Li |
| 상태 | 고체 |
| 원자량 | 6.941 |
| 녹는점 | 179℃ |
| 끓는점 | 1,317℃ |
| 원자가 | 1 |
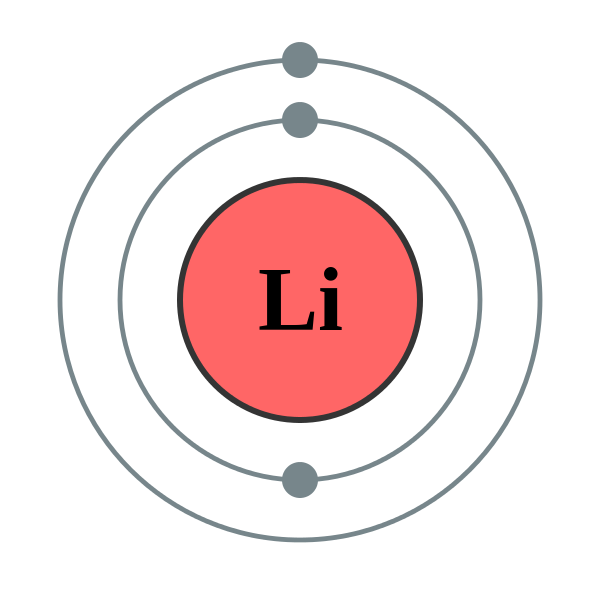
| 전자배열 | 2-1 또는 1s22s1 |
| 비중 | 0.534(20℃) |

고체원소 중에 가장 가벼우며, 연하고 빛나는 백색 금속으로 금속 그 자체로 쓰이거나 공업적으로 여러 가지 합금 및 리튬 화합물을 만드는 데 쓰인다.
1817년 요한 아우구스트 아르페드손이 광물 페탈라이트에서 발견했는데, 스포듀민·레피돌라이트·앰블리고나이트·트리필라이트 등의 광물에 미량 존재하며, 지각의 0.002%를 차지한다. 광석을 화학처리하면 수산화리튬(LiOH)·탄산리튬·황산리튬 등이 얻어지며, 이것들은 다른 화합물을 만드는 데에도 쓰인다.

리튬 금속은 리튬과 염화칼륨의 용융 혼합물을 전기분해해 얻는다. 납보다는 연하나 다른 알칼리 금속보다는 단단한 체심입방격자 결정구조를 가지는 물질로 잡아늘여 선으로 만들거나 잘 펴서 얇은 판으로 만들 수 있다. 리튬과 리튬 화합물의 불꽃반응은 심홍색을 띠기 때문에 정성분석에 이용된다. 리튬은 물에 뜨며, 물과 반응해 수산화리튬과 수소기체를 만든다. 대기 중에서 습기와 반응하기 때문에 바셀린을 칠해서 보관한다.
천연 리튬은 2개의 동위원소 7Li(92.5%)과 6Li(7.5%)으로 존재하며, 3개의 방사성 동위원소 5Li, 8Li, 9Li를 만들 수 있으나 반감기는 모두 1초 미만이다. 리튬은 1932년 존 코크로프트와 어니스트 월턴이 원자입자를 가속시켜 인공핵변환시키는 선구적인 실험(리튬 핵이 하나의 양성자를 흡수해 2개의 헬륨 핵이 됨)에서 과녁 금속으로 사용되었다(→ 리튬-7, 리튬-6). 6Li과 느린 중성자를 충돌시키면 헬륨과 삼중수소가 만들어진다. 알루미늄·납과 그외의 연한 금속에 리튬을 소량 가해 만든 합금은 단단하다.
리튬 화합물
리튬은 화학적으로 반응성이 크며, 전자 3개 중 하나를 쉽게 잃어서 리튬(Li+) 이온을 포함하는 화합물을 만든다. 대부분의 리튬 화합물은 다른 알칼리 금속 화합물과 용해도가 매우 다르고 그 화합물의 용도는 크다. 수소화리튬(LiH)은 백색의 결정성 고체로 금속 리튬과 수소기체를 직접 반응시켜 만들며, 물과 반응하면 수소기체를 빠르게 발생시키므로 수소발생제로 쓰인다.
또한 수소화알루미늄리튬(LiAlH4)을 만드는 데도 쓰이며, 이것은 알데하이드·케톤·카복실산을 알코올로 바꾸는 강력한 환원제이다. 수산화리튬(LiOH)은 보통 탄산리튬과 석회를 반응시켜 얻으며, 스테아르산과 다른 지방산의 리튬염(비누)을 만드는 데 쓰인다. 이러한 비누들은 윤활 그리스의 침전농축제로 널리 쓰인다. 또한 수산화리튬은 알칼리 축전지의 전해질 첨가제와 이산화탄소 흡착제로 쓰인다. 그밖의 염화리튬(LiCl)과 브로민화리튬(LiBr)을 사용하면 넓은 온도영역에서 습기를 흡수할 수 있는 농축염수를 만들 수 있는데, 이 염수는 보통 대형 냉동기와 공기정화기에 쓰인다. 플루오린화리튬(LiF)은 주로 법랑과 유리의 융제로 쓰인다. 탄산리튬(Li2CO3)은 다른 리튬 화합물 제조뿐만 아니라 효과적인 조울증 치료제로 쓰인다.
유기 리튬 화합물에서 리튬 원자는 리튬 이온(Li+)으로 존재하지 않고 직접 탄소원자에 결합되어 있는데 다른 유기화합물 제조에 사용된다. 부틸리튬(C4H9Li)은 브로민화부틸(C4H9Br)과 리튬 금속을 반응시켜 얻는데, 합성고무 제조에 사용된다.