루비듐
다른 표기 언어 Rubidium| 분류 | 알칼리 금속 |
|---|---|
| 원자번호 | 37 |
| 원소기호 | Rb |
| 상태 | 고체 |
| 원자량 | 85 |
| 녹는점 | 38.9℃ |
| 끓는점 | 688℃ |
| 원자가 | 1, 2 |
| 전자배열 | 2-8-18-8-1 또는 (Kr)5s |
| 비중 | 1.53(20℃) |

루비듐(Rubidium)
알칼리 금속 중에서 2번째로 반응성이 강하며 매우 연하고, 은백색의 광택이 있는 부드러운 금속이다. 1861년 구스타프 키르히호프와 로베르트 분젠이 분광학적 연구를 통해 발견했고, 분광 스펙트럼상의 2개의 선명한 적색선을 따서 명명했다.
레피돌라이트·폴류사이트·카널라이트에서 산출된다. 레피돌라이트에서 리튬을 추출한 후, 남아 있는 알칼리 금속의 탄산염을 포함한 혼합물에서 소량의 루비듐을 얻을 수 있다. 공기 중에서는 저절로 불이 붙는다. 물과 격렬하게 반응하여 수산화루비듐(RbOH)과 수소기체를 발생하며, 불꽃을 내며 타므로 광유(鑛油)나 수소기체 안에 보관한다. 광전지 또는 밀봉된 전자관(電子管) 속에 미량으로 들어 있는 기체를 연소하여 없애는 게터(getter)로 사용된다.
루비듐 원자시계가 제조되었지만 이는 세슘 원자시계보다는 정확하지 않다. 또한 태양계 밖의 우주 탐사용 로켓의 플라스마 추진력을 내는 작동유체(作動流體)로 제안되기도 했다.
천연 루비듐은 지각의 약 0.03%를 구성한다. 2개의 동위원소가 85Rb(72.15%), 방사성 87Rb(27.85%)으로 혼합되어 존재한다. 79Rb에서 95Rb까지 15개의 방사성 동위원소가 인공적으로 만들어졌다. 운석 속에 존재하는 87Rb과 87Sr의 비율을 토대로 태양계의 나이를 46억 년으로 추정한다. 원자가가 1이므로 1개의 원자가전자를 쉽게 잃는다.
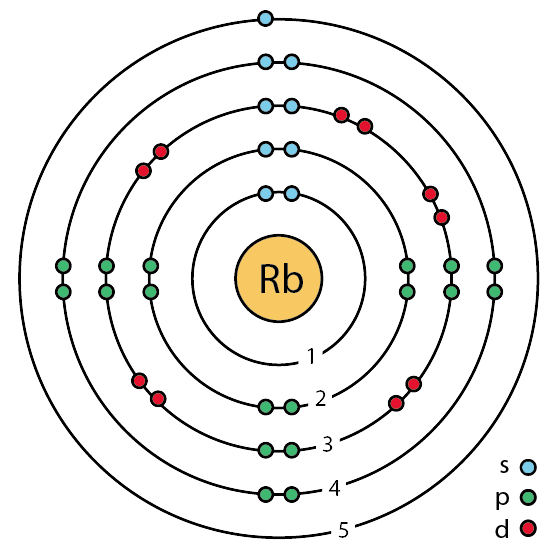
37 rubidium (Rb) enhanced Bohr model