규소
다른 표기 언어 Silicon| 분류 | 준금속 |
|---|---|
| 원자번호 | 14 |
| 원소기호 | Si |
| 상태 | 고체 |
| 원자량 | 28 |
| 녹는점 | 1,412℃ |
| 끓는점 | 2,355℃ |
| 밀도 | 2.42g/ml |
| 산화수 | +4 |
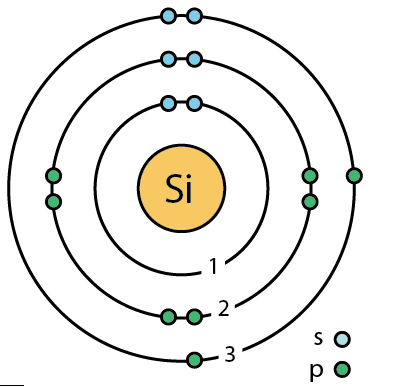
| 전자배열 | 2-8-4 또는 1s22s22p63s23p2 |

지각의 27.7%를 차지하며, 산소 다음으로 2번째로 풍부하게 존재한다. 1824년 스웨덴의 화학자 베르셀리우스에 의해 처음으로 분리되었으며, 천연에서는 유리상태로 산출되지 않는다. 그러나 산소와 결합하여 실리카(이산화규소 SiO2)로 또는 산소·알루미늄·마그네슘·칼슘·소듐·포타슘이나 철과 같은 다른 원소들과 결합하여 규산염 형태로 모든 암석뿐만 아니라 모래·점토·토양에서 산출된다. 또한 모든 천연수와 대기(규소진), 여러 식물들이나 뼈·조직 및 일부 동물의 체액 속에서도 발견된다.
순수한 규소는 단단한 암회색 고체로 금속성 광택을 갖고 있으며, 탄소와 비슷한 다이아몬드형 결정격자구조를 가지므로 다이아몬드와 물리적·화학적 성질이 비슷하다. 규소는 무정형인 갈색 분말형태 외에도 미세결정 구조를 갖기도 한다. 상업적으로 규소는 전기로에서 코크스와 반응하며 산화물들을 환원시켜 만든다. 소량의 규소제조에는 산화물을 알루미늄으로 환원하여 얻기도 한다.
상온에서 규소는 탄소처럼 상대적으로 비활성이나 가열된 규소는 할로젠 원소(플루오린·염소·브로민·아이오딘)와 격렬하게 반응하여 할로젠화물을 만들거나, 다른 금속들과 반응하여 규화물을 만들며, 플루오린화수소산 외의 산에는 부식되지 않는다. 적열상태의 규소는 수증기나 산소와 반응하여 이산화규소 피막을 형성한다. 온도가 2,000~2,600℃ 되는 전기로에서 규소와 탄소를 결합시키면 중요한 연마제인 탄화규소(카보런덤 SiC)가 만들어진다. 수소와 반응한 규소는 상온에서 기체상태인 일련의 수소화물·실레인(silane:수소화규소)을 형성하며, 탄화수소와 결합하여 일련의 유기 규소화합물이 생성된다.

규소 원소는 용도가 적다. 야금에서 환원제나 강철·청동·황동의 합금원소로 사용된다. 순도가 높은 규소는 광전기 장치나 트랜지스터, 기타 전자부품의 제조에 쓰인다. 가장 중요한 규소화합물로 이산화규소와 여러 규산염을 들 수 있다. 모래나 점토형태의 실리카는 고온용 기기의 굴절 재료뿐만 아니라 콘크리트나 벽돌을 만드는 데 쓰인다. 이는 석영광물과 함께 가열·용융되어 유리제품의 원료로 사용된다. 규산염은 대부분 물과 반응하지 않으므로 유리잔이나 법랑 제조, 옹기·자기 및 기타 세라믹 물질의 제조에 사용된다. 일반적으로 물유리 혹은 규산나트륨으로 알려진 규산소듐은 비누나 목재의 부식 방지, 계란의 보존, 시멘트, 염색 등에 사용된다.
규소는 합성유기 규소산화물로 규소·산소·탄소·수소 등의 원소로 이루어져 있다. 이들 규소는 화학적으로 비활성이고, 보통 고온에서 안정하므로 윤활제, 수압용 유체, 방수제, 광택제, 에나멜 등에 쓰인다.
천연에 존재하는 규소의 안정한 동위원소로는 28Si(92.21%), 29Si(4.7%), 30Si(3.09%) 등 3가지가 있다. 그밖에 4개의 방사성 동위원소가 발견되었다.