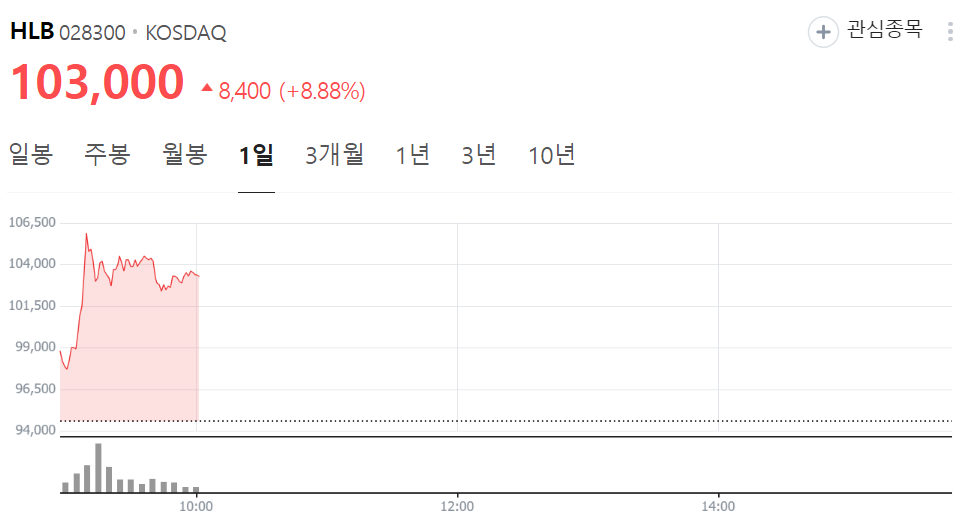
HLB '리보세라닙', FDA 승인 앞두고 주가 상승세
-
게시물 수정 , 삭제는 로그인 필요
HLB의 간암 신약 '리보세라닙' 품목허가 여부를 심사 중인 미국 식품의약국(FDA)의 발표가 다가오자, 투심이 살아나면서 HLB 주가가 급등하고 있는 모습을 보이고 있습니다.
FDA는 HLB의 표적항암제 리보세라닙과 중국 항서제약이 개발한 면역항암제 ‘캄렐리주맙’의 간암 1차 치료제에 대한 본심사를 마무리하고 16일(현지시간)까지 허가 여부를 결정할 예정입니다.
만약 리보세라닙이 승인된다면 국내 기업이 개발한 항암 치료제가 FDA 문턱을 넘는 첫 사례가 됩니다.
참고로 리보세라닙은 신생혈관 생성을 억제하여 암 세포의 성장과 전이를 방지하는 신약입니다.
그동안 신약에 대해 말도 많았고 탈도 많았지만, 리보세라닙은 '칼렘리주밥'에 이어 '플루조파립'과의 병용 치료에서 효과를 보이면서 FDA 승인 기대감이 커지고 있습니다.
'칼렐리주맙'은 면역 시스템의 공격으로부터 암세를 보호하는 기능을 차단하며, '플루조파립'은 암 세포의 DNA 복구를 방해하여 세포 사멸을 유도하는 약물입니다.
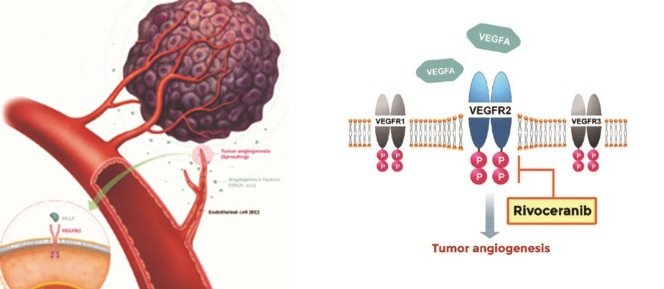
한편 HLB가 2022년 유럽종양학회(ESMO)에서 발표한 임상 3상 결과에 따르면, 리보세라닙과 캄렐리주맙 병용 요법 투여군의 생존 기간(OS)은 22.1개월이었습니다.
간암 1차 치료제 중 가장 생존 기간이 긴 로슈의 표적항암제 '아바스틴'과 면역항암제 '티쎈트릭' 병용 요법(19.2개월)에 비해 생존 기간이 더 긴 것이죠.
하지만 앞선 임상에서 아시아인과 B형간염바이러스(HBV)로 인한 간암 환자 비중이 높았던 데다 고혈압 등 부작용이 나타날 수 있다는 우려 때문에 FDA 승인에 대한 의구심이 커졌습니다.
그러나 지난해 10월 중국 준시바이오와 코헤루스가 개발한 신약이 FDA로부터 재발·전이성 비인두암 1차 치료제 승인을 받으면서 그러한 우려가 해소된 것입니다.
HLB는 리보세라닙을 미국 내 상업화 준비에 박차를 가하고 있는데, 당초 올 9월 초 판매 개시를 목표로 했으나 8월 중순으로 시점을 앞당기기 위해 마케팅 인력을 대거 채용하고 있는 중이라고 합니다.
또 중국 파트너사인 항서제약과 협력해 생산 준비도 마친 상황입니다.
항서제약은 이미 대량 생산 체제를 갖추고 원가율을 낮춘 상태인데, 이에 HLB는 낮은 원가율만큼 높은 수익성을 거둘 것으로 예상됩니다.

다만 일각에서는 FDA 승인에 성공하더라도, 매출이 불투명할 수도 있다는 전망이 나오고 있습니다.
기존 간암 1차 치료제 시장 1위인 로슈는 물론 브리스톨마이어스스퀴브(BMS)의 ‘옵디보’와 ‘여보이’ 병용 요법 등과 추후 경쟁이 예상되기 때문입니다.
아직 BMS가 진행 중인 임상 3상 세부 데이터는 아직 공개되지 않았기에 '리보세라닙'이 무조건 우세하다는 예상은 오히려 독이 될 수도 있다는 예측을 내놓고 있습니다.
