2024 HLB 리보세라닙
-
게시물 수정 , 삭제는 로그인 필요

간암치료제로 리보세라닙이 주목받고 있습니다. HLB의 자회사 Elevar Therapeutics에서는 암에서 신생혈관형성을 막아 치료하는 항암제로 혈관 내피 수용체(VEGFR-2)의 저분자 억제제로 선택성이 높으며 부작용이 적은 경구용 함암제인 리보세라닙을 FDA NDA 본 심사 진행 중에 있습니다.(포스트 작성일 기준)
HLB 리보세라닙(Rivoceranib)
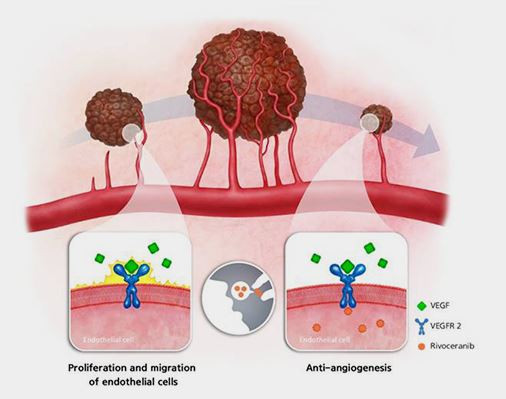
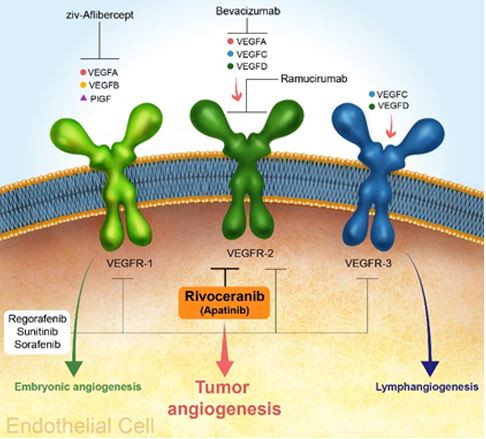
리보세라닙은 혈관내피세포성장인자 수용체 2(VEGFR-2)를 타겟으로 하는 표적항암제입니다. 모든 형태의 고형암은 성장과 전이를 위해 혈관을 통한 혈액 공급이 필요하며, 이때 VEGFR-2는 혈관 형성에 중요한 역할을 합니다. 고형암에서 신생혈관의 생성은 세포에서 방출된 VEGF와 VEGFR-2가 결합하여 활성화됩니다.
이때 활성화된 VEGFR-2는 혈관 생성에 관여하는 하위 신호전달 체계를 활성화시켜 새로운 혈관 생성을 유도하게 됩니다. 고형암의 치료를 위해 사용 중인 기존의 저분자 화합물 형태의 혈관생성억제제는 부작용이 심하여 사용이 제한됩니다. 기존의 신생혈관억제제에서 부작용이 나타나는 것은 혈관 생성을 억제하는 수용체(Receptor)에 대한 선택적인 결합력이 낮기 때문에, 표적이 되지 않는 혈관형성에 동시에 억제하여 부작용이 많이 나타났습니다. 그러나 리보세라닙은 VEGFR-2에 선택적인 저분자(TKI) 억제제로서, VEGF-2 수용체에 선택적으로 작용하여, 부작용이 적으며 수용체에 매우 선택적이므로 작용하여 종양의 신생혈관의 생성을 방해하여 고형암 치료를 효과적으로 억제해 줍니다.

HLB 리보세라닙 임상시험
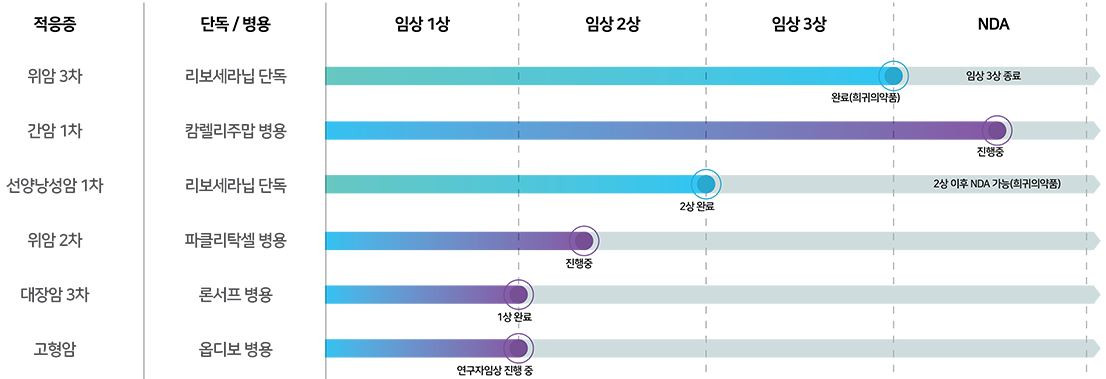
HLB가 5월 현시점에 임상시험 3상 리보세라닙과 칼렐리주맙 병용요법에서 간암 1차 치료제 허가에 대하여 승인을 앞두고 있습니다. 임상시험 결과보고서에 따르면, baseline 진행한 환자는 543명이고, sorafenib arm 271명과 리보세라닙+칼렐리주맙 arm 272명에 대하여, 임상시험을 진행하였습니다. 간암환자의 생존 기간(Overall survival) 이 무려 약 7개월 앞서 리보세라닙+칼렐리주맙(22.1개월), Sorafenib(15.2 개월)에 대한 유효성이 확인되었습니다. 전 세계 간암환자 및 보호자분들에게 이렇게 결과가 좋은 항암제가 승인이 나면, 얼마나 큰 힘이 될지 기대가 매우 큽니다.
그 외에도 고형암 1차 치료제 위암 2차 및 3차치료제, 선양낭성암 1차치료제 등을 진행하고 있으며, 추후 FDA 승인 후 리보세라닙의 파이프라인은 고형암에 적용되어 많은 환자와 환자의 보호자들에게 이로운 뉴스가 계속 나왔으면 좋겠습니다.
 이미지출처- HLB 홈페이지
이미지출처- HLB 홈페이지



ASCO(미국암학회)에서 리보세라닙 추적관찰 결과분석 발표예정
Abstract 4110 및 e16197 이 2024년 세계적인 암학회 ASCO에 발표가 됩니다. 관련하여, 직접 방문하고 자회사인 Elevar Therapeutics 부스도 다녀오고 싶지만, 리보세라닙의 역사적으로 가장 긴 생존추적기간에 대한 임상시험 관련 논문이 매우 궁금합니다. 금번 2024년 ASCO에서는 글로벌 3상 추적관찰결과 분석 외에도 리보세라닙 관련 18건의 연구결과가 발표된다고 합니다. HLB 간암치료제인 리보세라닙은 FDA승인이 된다면, ASCO에서 발표되는 18건의 임상시험 개수보다 더 많은 고형암에 연계되는 논문과 발표가 지속될 것이라고 생각합니다.



HLB 리보세라닙 NCCN 등재신청
NCCN은 항암관련하여, 표준 치료 및 항암에 대한 가이드라인을 말하는 것으로, 항암과 관련된 종사자의 필수 가이드라인이라고 보시면 됩니다. 이런 국제적 가이드라인에, HLB가 리보세라닙과 칼렐리주맙 병용요법으로 간암 1차 치료에 우선권고 등재 신청을 하였는데요, FDA 승인이 된다는 가정 하에 NCCN까지 등재가 된다면 리보세라닙의 파격은 엄청날 것으로 보입니다. 글로벌 제약회사에서 항암제 임상시험이 허가된다는 것도 매우 놀라울 일인데 가이드라인에 리보세라닙이 1차 치료제로 등재가 되면, 1차 치료의 기준이 되는 것입니다.